A Química Analítica envolve métodos voltados para a determinação da composição da matéria. Os métodos qualitativos geram informações sobre a identidade das espécies atômicas ou moleculares ou mesmo grupos funcionais na amostra. Já os métodos quantitativos proporcionam resultados numéricos relacionados à quantidade dos componentes na amostra.
Classificação dos métodos analíticos :
Os métodos analíticos podem ser classificados em Clássicos ou Instrumentais.
Métodos Clássicos :
No início do desenvolvimento da Química, a maioria das análises empregavam a separação dos componentes de interesse (os analitos) por técnicas como precipitação, extração ou destilação. Para análises qualitativas, os componentes separados eram então tratados com reagentes que em contato com o analito produziam compostos identificados pela sua cor, solubilidade, pontos de fusão e ebulição, etc. Assim as espécies químicas eram identificadas. A quantificação dos analitos (elementos de interesse numa análise) pode ser feita através de técnicas simples mas muito precisas, que estão em pleno uso até os dias atuais, como a volumetria (titulações) e a gravimetria (medidas de massa)
Esses métodos clássicos de separação e determinação de analitos ainda são muito utilizados devido à relativa simplicidade de equipamentos necessários e confiabilidade de resultados obtidos.
Métodos Instrumentais :
No início do século 20, os químicos passaram a explorar outros fenômenos distintos daqueles observados nos métodos clássicos para resolver problemas analíticos. Com isso, medidas de propriedades físicas dos analitos tais como a condutividade elétrica, absorção ou emissão de luz passaram a ser utilizadas na análise quantitativa de uma grande variedade de analitos inorgânicos, orgânicos e biológicos. Com isso, novas técnicas como a cromatografia líquida de alta eficiência, espectroscopia e técnicas eletroanalíticas passaram a ser utilizadas para a realização de análises cada vez mais sofisticadas. Esses novos métodos de separação e determinação de espécies químicas passaram a ser conhecidos como métodos instrumentais de análise. Seu crescimento foi favorecido pelo avanço tecnológico dos dispositivos eletrônicos e dos computadores.
A maioria dos equipamentos analíticos modernos possuem ou estão conectados a um ou mais dispositivos eletrônicos sofisticados capazes de detectar e registrar dados relativos aos analitos. Esses dispositivos podem ser amplificadores, circuitos integrados, microprocessadores ou mesmo computadores. De fato existem máquinas que apresentam uma imensa complexidade enquanto outras são mais simples. O cientista deve definir o problema e então decidir o método mais apropriado para solucioná-lo de acordo com suas condições. A Química Analítica Instrumental, devido ao nível de desenvolvimento alcançado a à consequente complexidade adquirida, divide-se de acordo com os métodos de análise utilizados na identificação e quantificação do analito. Os métodos Espectrométricos, por exemplo, utilizam conhecimentos relacionados com a interação entre a luz e a matéria. Entre eles destacam-se a Espectrometria de Absorção Atômica, Espectrometria de Absorção Molecular, Espectrometria de Emissão Atômica, entre outras técnicas. Diversas outras características específicas das espécies químicas são exploradas na Química Analítica. Os métodos eletroanalíticos são capazes de determinar analitos a partir de seus potenciais padrão de redução. Esses métodos envolvem técnicas como a Potenciometria, Coulometria e os diversos tipos de Voltametria.
Referências :
Principles of Instrumental Analysis, D. A. Skoog, J. J. Leary., Saunders College Publishing, 1992
Introdução à Semimicroanálise Qualitativa, N. Baccan.,L.M.Aleixo.,E.Stein,O.E.S.Godinho, Editora da Unicamp, 1988.
Chemical Analysis: an advanced text and reference, H.A.Laitinen, W. Edgard, Mc Graw-Hill,1975
domingo, 28 de junho de 2009
sexta-feira, 26 de junho de 2009
Biologia com Química, olha o que dá!
A Bioquímica é, como o próprio nome indica, a química da vida. É o ramo da ciência que faz a ponte entre a Química, estudo das estruturas e interacções entre átomos e moléculas, e a Biologia, estudo das estruturas e interacções das células e organismos vivos. Visto que todos os seres são constituídos por moléculas "inanimadas", a vida é no seu nível mais básico um fenómeno bioquímico.Embora os seres vivos sejam todos muito diferentes ao nível macroscópico, verifica-se que exibem semelhanças muito pronunciadas ao nível da sua bioquímica, nomeadamente na forma que utilizam para guardar e transmitir a informação genética (no DNA) e na série de reacções que utilizam na produção de energia, síntese e degradação de blocos constituintes/biomoléculas (as vias metabólicas). A Bioquímica constitui um tema de estudo unificante de todos os seres e da vida em si. É apenas ao nível bioquímico e não pelo aspecto macroscópico, que se pode afirmar com alguma certeza que todos seres tiveram um ancestral comum.A Bioquímica é um campo altamente interdisciplinar, que já há muito deixou de ser apenas os estudo de séries de reacções na célula, no entanto podem-se definir alguns pontos importantes do seu estudo:Vias de síntese e degradação das biomoléculasDeterminação das propriedades químicas e estrutura tridimensional das biomoléculasMecanismos de regulação das inúmeras reacções que ocorrem em simultâneo na célula e no organismoFunções das proteínas: mecanismos moleculares da catálise enzimática; reconhecimento e ligação pelos receptores celulares, seu mecanismo intra e intermolecular; formas como a informação é comunicada em vias de transdução de sinalExpressão da informação genética, sua transmissão e actualmente, na era pós-genómica, da sequência genética à função (proteómica)Os conhecimentos bioquímicos nunca são estanques tendo elevada aplicabilidade nas áreas mais diversas como a medicina e ciências da saúde, indústrias farmacêutica, alimentar e química e na biotecnologia, que actualmente se vê no topo dos investimentos de várias empresas muito por causa dos conhecimentos de bioquímica e biologia molecular que se acumularam na última metade do séc. XX. 
Fonte: http://www.anbioq.org/node/31

Fonte: http://www.anbioq.org/node/31
As Reações químicas e a Formação das cavernas
As cavernas formam-se normalmente em áreas de rochas calcárias, embora na zona costeira possam ocorrer em outros tipos de rochas. As rochas calcárias são formadas por calcita (carbonato de cálcio, CaCO3), que dissolvem-se quando entram em contato com a água
 (Gruta São Mateus II- Goiás)
(Gruta São Mateus II- Goiás) que contém suficiente teor de ácidos. Estes são provenientes da chuva ácida ou do dióxido de carbono (CO2) existente na atmosfera e na decomposição da matéria orgânica, que em contato com a água formam o ácido carbônico, H2CO3.
Num segundo momento, a água ácida penetrando pelas fendas do calcário ataca a rocha, produzindo o bicarbonato de cálcio (Ca(HCO3)2), que é solúvel e facilmente transportado pela água. Com a dissolução do bicarbonato de cálcio, as fendas vão-se alargando lentamente e formando as cavernas.
Vamos ver como tudo isso pode ser escrito através das equações químicas?
1- Acidulação da água (formação do ácido carbônico):

2- Dissolução da rocha pelo ácido carbônico:

As águas da chuva, aciduladas pelo gás carbônico da atmosfera e do solo, ao penetrarem pelas fendas da rocha calcária, vão dissolvendo-a e transportando o bicarbonato de cálcio (Ca(HCO3)2) em solução até emergirem no teto de uma caverna pré-existente.

(Gruta do Lago Azul-Bonito)
A gota, ao cair, ainda carrega consigo bicarbonato de cálcio (Ca(HCO3)2) em solução, o qual vai sendo depositado no piso logo abaixo, formando uma estalagmite. O crescimento oposto da estalactite e da estalagmite faz com que essas peças muitas vezes se unam, dando origem à colunas.
Vamos ver a equação química que expressa este fenômeno?
3- Precipitação do carbonato de cálcio:

Abaixo temos um esquema que representa resumidamente tudo que aprendemos. Vamos revisar?

Fonte: www.geocities.com
quinta-feira, 25 de junho de 2009
CORES
Muitas propriedades da matéria podem ser explicadas pela estrutura molecular e pelas interações entre moléculas. É o caso da dureza, dos pontos de fusão e ebulição, da densidade e também da cor. Porém, a avaliação dessa última propriedade a partir da estrutura molecular não é simples. Sabemos que a luz interage com a matéria, sendo em parte absorvida e em parte refletida. É essa cor refletida que percebemos como a cor do material. Nada mais natural, então, que começar lembrando o que é luz. O problema, é que, parafraseando o físico Richard Feynman, a luz "não se parece com nada que você já tenha visto". Nadinha mesmo. A luz é uma onda eletromagnética, cuja energia é mediada por fótons - partículas sem massa ou carga, mas dotadas de energia. Parte das propriedades da luz que conhecemos - trajetória retilínea, por exemplo - pode ser explicada pensando na luz como partícula, mas propriedades como a difração exigem que se pense na luz como uma onda. Muito do que se sabe sobre a luz e os fótons foi determinado no último século; para o que se pretende explicar aqui, a idéia da luz-partícula é mais simples. Digamos que a luz é "feita" de fótons, partículas que possuem uma energia relacionada à sua frequência. Quanto mais alta a freqüência da luz, maior a sua energia, e menor o seu comprimento de onda. A luz que enxergamos - aquela que, portanto, tem cor - é apenas uma faixa estreita do espectro eletromagnético, que compreende também as ondas de rádio, luz infravermelha, ultravioleta, raios X e raios gama. A luz que "vemos" é a que tem comprimento de onda entre cerca de 400 e 700nm:


Por que vemos essa faixa de cores?
Porque o nosso olho é sensível a essa faixa do espectro eletromagnético. Essa resposta parece óbvia, já que os olhos evidentemente evoluíram para perceber essa faixa de luz; mas o fato é que nem toda a luz interage do mesmo jeito com a matéria.
Segundo, que é preciso de mais energia para romper ligações mais fortes - pontes de hidrogênio e ligações iônicas, por exemplo. Terceiro, que as radiações UVB, tem muita energia, o que explica a sua periculosidade. Mas espere: se a radiação UV é tão energética, não poderia ser enxergada? Poderia sim, e vários pássaros e insetos são capazes de perceber luz na faixa ultravioleta. Ocorre que energia demais acaba interagindo de forma a ionizar as substâncias, o que dificulta o funcionamento reversível dos sistemas óticos. A figura a seguir ilustra a principal transformação responsável pela visão, a isomerização do cis-retinal ligado a uma proteína, a opsina:

Nessa transformação, um fóton é absorvido por um elétron da ligação indicada. A ligação deixa de ser dupla, por um momento, o que permite que amolécula gire, formando o isômero trans- e gerando uma cascata de transformações que culmina na emissão de um impulso nervoso.
A propósito, lembre que ligações simples podem girar sem romper, enquanto duplas não podem:
A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha. A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha.
A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha.
 Curiosamente, a cor pode ser percebida tanto como um comprimento de onda puro, quanto com algumas combinações de cores (cores metaméricas). Um exemplo: o efeito de um pouquinho de luz azul, um pouco mais de verde e uma boa dose de vermelho causa o mesmo efeito nos cones que um único feixe de luz alaranjada. Esse efeito é explorado em televisões ou monitores, em que os componentes vermelho, verde a azul (em inglês, a sigla é RGB) formam todos os "milhões de cores" que o monitor oferece.
Curiosamente, a cor pode ser percebida tanto como um comprimento de onda puro, quanto com algumas combinações de cores (cores metaméricas). Um exemplo: o efeito de um pouquinho de luz azul, um pouco mais de verde e uma boa dose de vermelho causa o mesmo efeito nos cones que um único feixe de luz alaranjada. Esse efeito é explorado em televisões ou monitores, em que os componentes vermelho, verde a azul (em inglês, a sigla é RGB) formam todos os "milhões de cores" que o monitor oferece.
Porque o nosso olho é sensível a essa faixa do espectro eletromagnético. Essa resposta parece óbvia, já que os olhos evidentemente evoluíram para perceber essa faixa de luz; mas o fato é que nem toda a luz interage do mesmo jeito com a matéria.
Segundo, que é preciso de mais energia para romper ligações mais fortes - pontes de hidrogênio e ligações iônicas, por exemplo. Terceiro, que as radiações UVB, tem muita energia, o que explica a sua periculosidade. Mas espere: se a radiação UV é tão energética, não poderia ser enxergada? Poderia sim, e vários pássaros e insetos são capazes de perceber luz na faixa ultravioleta. Ocorre que energia demais acaba interagindo de forma a ionizar as substâncias, o que dificulta o funcionamento reversível dos sistemas óticos. A figura a seguir ilustra a principal transformação responsável pela visão, a isomerização do cis-retinal ligado a uma proteína, a opsina:

Nessa transformação, um fóton é absorvido por um elétron da ligação indicada. A ligação deixa de ser dupla, por um momento, o que permite que amolécula gire, formando o isômero trans- e gerando uma cascata de transformações que culmina na emissão de um impulso nervoso.
A propósito, lembre que ligações simples podem girar sem romper, enquanto duplas não podem:
A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha.
 A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha.
A luz necessária, em se tratando de bastonetes, é de mais ou menos 498nm. Para os três tipos de cones, S, M e L (as células responsáveis pela percepção de cores) há respectivamente três comprimentos de onda: em torno de 420nm, para a percepção de luz azul; 534nm, para a luz verde; e 564nm, para a luz vermelha. Curiosamente, a cor pode ser percebida tanto como um comprimento de onda puro, quanto com algumas combinações de cores (cores metaméricas). Um exemplo: o efeito de um pouquinho de luz azul, um pouco mais de verde e uma boa dose de vermelho causa o mesmo efeito nos cones que um único feixe de luz alaranjada. Esse efeito é explorado em televisões ou monitores, em que os componentes vermelho, verde a azul (em inglês, a sigla é RGB) formam todos os "milhões de cores" que o monitor oferece.
Curiosamente, a cor pode ser percebida tanto como um comprimento de onda puro, quanto com algumas combinações de cores (cores metaméricas). Um exemplo: o efeito de um pouquinho de luz azul, um pouco mais de verde e uma boa dose de vermelho causa o mesmo efeito nos cones que um único feixe de luz alaranjada. Esse efeito é explorado em televisões ou monitores, em que os componentes vermelho, verde a azul (em inglês, a sigla é RGB) formam todos os "milhões de cores" que o monitor oferece.terça-feira, 23 de junho de 2009
Química - Profissão, Carreira e Informações Gerais
Habilitação:Químico
Duração do Curso: 4 anos
Área: Exatas
Atributos do Profissional: Observação e Raciocínio Lógico
Salário Médio: R$ 2032,00
O papel do Químico é usar os conhecimentos e propriedades químicas conhecidas para criar novas substâncias tais como medicamentos, fertilizantes, cosméticos, etc… Conheça mais sobre a carreira de químico.
Carreira de Qúimico
A Química é a ciência que estuda a matéria, sua composição e as transformações pelas quais a mesma passa. A química está presente em quase todas as indústrias e atividades humanas, desde a produção de fertilizantes para as colheitas até a produção de combustível para foguetes.
A principal atribuição do Químico é usar os conhecimentos e propriedades químicas conhecidas para criar novas substâncias, melhorar processos industriais, produzir medicamentos, cosméticos, além de realizar pesquisas em áreas tais como energia desenvolvendo novos combustíveis e processos químicos para baterias.
Especializações da Carreira em Química
Basicamente há 3 caminhos que o químico pode seguir na sua carreira: química industrial, química pura e aplicada e licenciatura. Optando por Química Industrial o químico vai atuar desenvolvendo novos produtos, materiais e processos químicos industriais, testando a qualidade de produtos e trabalhando no tratamento de poluição e resíduos. Na Química Pura e Aplicada, o químico irá atuar como pesquisador, investigando novas substâncias, suas propriedades tóxicas, energéticas, etc… Na carreira de Licenciatura o foco do químico será a sala de aula, lecionando química em escolas e universidades.
Grade Básica do Curso de Química:
- Cálculo
- Química Inorgânica
- Química Industrial
- Química Analítica
- Química Orgânica
- Fisco - Química
- Física
- Eletro-quimica
- Mineralogia
- Laboratório Prático de Química

Carreira de Químico: Aspectos Favoráveis
O Petróleo atualmente apresenta duas boas oportunidades de trabalho para os químicos, a primeira é trabalhar como especialista, atuando na indústria petrolífera que no Brasil tende a crescer muito nos próximos anos devidos as novas descobertas do presente, a segunda é o oposto, trabalhar pesquisando novas formas de energia e combustíveis para o futuro.
Carreira de Químico: Aspectos Desfavoráveis
O aspecto desfavorável fica por conta da falta de estímulo a pesquisa e das condições ruins que alguns centros de pesquisa Brasileiros apresentam devido a falta de investimentos.
Duração do Curso: 4 anos
Área: Exatas
Atributos do Profissional: Observação e Raciocínio Lógico
Salário Médio: R$ 2032,00
O papel do Químico é usar os conhecimentos e propriedades químicas conhecidas para criar novas substâncias tais como medicamentos, fertilizantes, cosméticos, etc… Conheça mais sobre a carreira de químico.
Carreira de Qúimico
A Química é a ciência que estuda a matéria, sua composição e as transformações pelas quais a mesma passa. A química está presente em quase todas as indústrias e atividades humanas, desde a produção de fertilizantes para as colheitas até a produção de combustível para foguetes.
A principal atribuição do Químico é usar os conhecimentos e propriedades químicas conhecidas para criar novas substâncias, melhorar processos industriais, produzir medicamentos, cosméticos, além de realizar pesquisas em áreas tais como energia desenvolvendo novos combustíveis e processos químicos para baterias.
Especializações da Carreira em Química
Basicamente há 3 caminhos que o químico pode seguir na sua carreira: química industrial, química pura e aplicada e licenciatura. Optando por Química Industrial o químico vai atuar desenvolvendo novos produtos, materiais e processos químicos industriais, testando a qualidade de produtos e trabalhando no tratamento de poluição e resíduos. Na Química Pura e Aplicada, o químico irá atuar como pesquisador, investigando novas substâncias, suas propriedades tóxicas, energéticas, etc… Na carreira de Licenciatura o foco do químico será a sala de aula, lecionando química em escolas e universidades.
Grade Básica do Curso de Química:
- Cálculo
- Química Inorgânica
- Química Industrial
- Química Analítica
- Química Orgânica
- Fisco - Química
- Física
- Eletro-quimica
- Mineralogia
- Laboratório Prático de Química

Carreira de Químico: Aspectos Favoráveis
O Petróleo atualmente apresenta duas boas oportunidades de trabalho para os químicos, a primeira é trabalhar como especialista, atuando na indústria petrolífera que no Brasil tende a crescer muito nos próximos anos devidos as novas descobertas do presente, a segunda é o oposto, trabalhar pesquisando novas formas de energia e combustíveis para o futuro.
Carreira de Químico: Aspectos Desfavoráveis
O aspecto desfavorável fica por conta da falta de estímulo a pesquisa e das condições ruins que alguns centros de pesquisa Brasileiros apresentam devido a falta de investimentos.
Chuva Ácida (experimento)
Experimento
Duração: aproximadamente 40 minutos.
Objetivos
Conscientizar o aluno de sua participação na emissão de gases poluentes que aumentam a acidez da atmosfera e conseqüentemente da chuva. Demonstrar a contribuição do SO2 para o aumento da acidez na chuva e discutir sobre a formação da chuva ácida, os malefícios da emissão de SO2, o transporte desse gás, os prejuízos que a chuva ácida causa, e como cada um pode contribuir para minimizar a acidez da chuva.
MATERIAS
1 vidro com tampa (como os de maionese ou café solúvel)
enxofre em pó (1 colher de chá cheia)
4 fitas de papel tornassol azul ( ~ 3 cm cada uma)
2 pétalas de flor colorida
1 colher de plástico
2 pedaços de fios de cobre ( ~ 15 cm cada um)
1 caixa de fósforos
1 caneta
PROCEDIMENTO
1 - Coloque uma fita de papel tornassol e uma pétala de flor na parte de dentro da tampa do vidro. Utilizando a colher de plástico, polvilhe um pouco do enxofre em pó sobre a fita e sobre a pétala (não utilize todo o enxofre, apenas o suficiente para manchar parte do papel tornassol e da pétala de flor). Anote suas observações na tabela de resultados.
2 - Coloque cerca de 5 cm de água da torneira no vidro, e com o auxílio da colher (limpa), retire um pouco de água e coloque sobre o enxofre que está sobre a pétala e o papel tornassol. Observe o que acontece com a água em contato com o enxofre, e se houve alteração na cor do papel tornassol e na pétala. Anote suas observações. Jogue no lixo o material sólido da tampa e lave a tampa.
3 - Pegue uma nova fita de papel tornassol e o umedeça com água. Anote suas observações.
4 - Monte o seguinte esquema Coloque em uma das extremidades do fio de cobre uma nova pétala e um pouco separado coloque um novo papel tornassol azul. Na outra extremidade do fio, faça um pequeno gancho e pendure por dentro do vidro que já tem um pouco de água. Tome cuidado para que a pétala ou fita não entrem em contato com a água. Veja a ilustração.
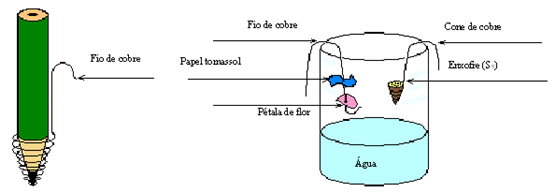
5 - Pegue o outro fio de cobre e enrole parte deste na ponta da caneta, formando um pequeno cone de cerca de 1 cm. Faça um pequeno gancho na outra ponta do fio, retire a caneta e encha o cone com enxofre em pó, com cuidado (use a colher). Pendure o fio de cobre por dentro do vidro (sem atingir a água).
6 - Posicione um fósforo aceso abaixo do cone para iniciar a queimar o enxofre e rapidamente retire o fósforo e tampe o vidro. Observe se o enxofre está realmente queimando. Aguarde 5 minutos e anote na tabela de resultados se houve mudança na coloração do papel e da pétala.
7 - Retire os fios de cobre de dentro do vidro rapidamente. Feche o vidro e agite a solução cuidadosamente.
8 - Umedeça nova fita de papel tornassol na água e anote suas observações.
PS. O papel tornassol azul é de cor azul em meio neutro e básico e se torna rosa em meio ácido.
NO FINAL DO EXPERIMENTO:
NÃO JOGUE A ÁGUA ACIDIFICADA NA PIA. Armazene esta solução contendo o ácido sulfuroso em um recipiente grande para posterior neutralização.
Jogue as pétalas e papel de tornassol no lixo. Os resíduos de enxofre podem ser jogados na pia, pois este elemento é bastante inerte. Lave todo material e retorne-os para sua bancada. Limpe e organize sua bancada.
Duração: aproximadamente 40 minutos.
Objetivos
Conscientizar o aluno de sua participação na emissão de gases poluentes que aumentam a acidez da atmosfera e conseqüentemente da chuva. Demonstrar a contribuição do SO2 para o aumento da acidez na chuva e discutir sobre a formação da chuva ácida, os malefícios da emissão de SO2, o transporte desse gás, os prejuízos que a chuva ácida causa, e como cada um pode contribuir para minimizar a acidez da chuva.
MATERIAS
1 vidro com tampa (como os de maionese ou café solúvel)
enxofre em pó (1 colher de chá cheia)
4 fitas de papel tornassol azul ( ~ 3 cm cada uma)
2 pétalas de flor colorida
1 colher de plástico
2 pedaços de fios de cobre ( ~ 15 cm cada um)
1 caixa de fósforos
1 caneta
PROCEDIMENTO
1 - Coloque uma fita de papel tornassol e uma pétala de flor na parte de dentro da tampa do vidro. Utilizando a colher de plástico, polvilhe um pouco do enxofre em pó sobre a fita e sobre a pétala (não utilize todo o enxofre, apenas o suficiente para manchar parte do papel tornassol e da pétala de flor). Anote suas observações na tabela de resultados.
2 - Coloque cerca de 5 cm de água da torneira no vidro, e com o auxílio da colher (limpa), retire um pouco de água e coloque sobre o enxofre que está sobre a pétala e o papel tornassol. Observe o que acontece com a água em contato com o enxofre, e se houve alteração na cor do papel tornassol e na pétala. Anote suas observações. Jogue no lixo o material sólido da tampa e lave a tampa.
3 - Pegue uma nova fita de papel tornassol e o umedeça com água. Anote suas observações.
4 - Monte o seguinte esquema Coloque em uma das extremidades do fio de cobre uma nova pétala e um pouco separado coloque um novo papel tornassol azul. Na outra extremidade do fio, faça um pequeno gancho e pendure por dentro do vidro que já tem um pouco de água. Tome cuidado para que a pétala ou fita não entrem em contato com a água. Veja a ilustração.

5 - Pegue o outro fio de cobre e enrole parte deste na ponta da caneta, formando um pequeno cone de cerca de 1 cm. Faça um pequeno gancho na outra ponta do fio, retire a caneta e encha o cone com enxofre em pó, com cuidado (use a colher). Pendure o fio de cobre por dentro do vidro (sem atingir a água).
6 - Posicione um fósforo aceso abaixo do cone para iniciar a queimar o enxofre e rapidamente retire o fósforo e tampe o vidro. Observe se o enxofre está realmente queimando. Aguarde 5 minutos e anote na tabela de resultados se houve mudança na coloração do papel e da pétala.
7 - Retire os fios de cobre de dentro do vidro rapidamente. Feche o vidro e agite a solução cuidadosamente.
8 - Umedeça nova fita de papel tornassol na água e anote suas observações.
PS. O papel tornassol azul é de cor azul em meio neutro e básico e se torna rosa em meio ácido.
NO FINAL DO EXPERIMENTO:
NÃO JOGUE A ÁGUA ACIDIFICADA NA PIA. Armazene esta solução contendo o ácido sulfuroso em um recipiente grande para posterior neutralização.
Jogue as pétalas e papel de tornassol no lixo. Os resíduos de enxofre podem ser jogados na pia, pois este elemento é bastante inerte. Lave todo material e retorne-os para sua bancada. Limpe e organize sua bancada.
terça-feira, 16 de junho de 2009
A QUÍMICA EM NOSSA VIDA
Quando o homem aprendeu a misturar e a reagir substâncias químicas, surgiram o sabão, a metalurgia, o vinho e a cerveja, e os medicamentos, entre outros produtos. Surgiram também algumas substâncias nocivas, como o CFC, que destrói a camada de ozônio, criando sérios problemas ao ambiente. Esse progresso acelerou-se enormemente com as descobertas tecnológicas do século XX. O aparecimento do plástico, o avanço da indústria de medicamentos, a descoberta da radiatividade, a síntese de matéria orgânica e a nova biotecnologia são alguns exemplos dessas inovações que transformaram e continuam transformando nossa existência.
A Química e a Física são responsáveis por grande parte das mudanças que acontecem em nossa vida e muitas vezes não percebemos isso. Existem milhares de exemplos de aplicação das descobertas científicas em nosso cotidiano. Por exemplo, você saberia explicar como funciona um extintor de incêndio? De onde são extraídos os pigmentos coloridos usados na indústria de cosméticos, de alimentos e de tintas? Como se produz o vidro e os medicamentos?
Estudar os fenômenos em que há transformação da matéria, ou seja, os fenômenos químicos, hoje em dia, é indispensável para todos os que querem entender melhor o mundo em que vivemos.
 Os antigos egípcios dispunham de uma grande gama de pigmentos que lhes permitia pintar o interior de tumbas e templos com uma riqueza de cores que pode ser apreciada ainda hoje.
Os antigos egípcios dispunham de uma grande gama de pigmentos que lhes permitia pintar o interior de tumbas e templos com uma riqueza de cores que pode ser apreciada ainda hoje.
A Química e a Física são responsáveis por grande parte das mudanças que acontecem em nossa vida e muitas vezes não percebemos isso. Existem milhares de exemplos de aplicação das descobertas científicas em nosso cotidiano. Por exemplo, você saberia explicar como funciona um extintor de incêndio? De onde são extraídos os pigmentos coloridos usados na indústria de cosméticos, de alimentos e de tintas? Como se produz o vidro e os medicamentos?
Estudar os fenômenos em que há transformação da matéria, ou seja, os fenômenos químicos, hoje em dia, é indispensável para todos os que querem entender melhor o mundo em que vivemos.
 Os antigos egípcios dispunham de uma grande gama de pigmentos que lhes permitia pintar o interior de tumbas e templos com uma riqueza de cores que pode ser apreciada ainda hoje.
Os antigos egípcios dispunham de uma grande gama de pigmentos que lhes permitia pintar o interior de tumbas e templos com uma riqueza de cores que pode ser apreciada ainda hoje.
quimica e o meio ambiente
IMPORTÂNCIA DA QUÍMICA PARA O MEIO AMBIENTE
A partir da década de 60 o mundo foi tomado por uma nova ordem. A informação transformou nosso planeta em um sistema único e cada vez mais integrado. Quando vimos a primeira fotografia do nosso planeta tirada de uma nave espacial, descobrimos que a Terra é azul, flutuando no espaço. Descobrimos também o perigo dos pesticidas, do lixo urbano e industrial e que nosso ar estava se tornando cada vez mais poluído. O modelo econômico, mostrava-se claramente sua capacidade de destruição do nosso Planeta. Além, disso a indústria química era vista como um mero transformador dos recursos naturais para o consumo humano sem se importar com os rejeitos impactantes ao meio ambiente.
Embora com toda a informação e discussão sobre as questões ambientais ainda ocorrem muita desinformação ou contra-informação, o que às vezes dificulta a escolha da melhor opção preventiva ou mesmo paliativa para o problema. Parte desta desinformação pode ser atribuída a um erro histórico dos químicos. Há quatro décadas, quando deixou-se a sociedade sem respostas quando se questionaram, por exemplo, os riscos inerentes ao uso do DDT, dos metais pesados e da emissão de gases causadores de efeito estufa, dentro outros. Vem dessa época também a disseminação de um sentimento de associar a química com o impactante, o nocivo, o sintético (não-natural).
Os avanços da química impactaram, por outro lado, em grandes benefícios para o ser humano, como mostra, no Brasil, os dados do recentes do IBGE. A expectativa de vida do brasileiro passou de 43,3 anos, na década de 50, para 68,1 aos em 1998. Para exemplificar alguns avanços da química: na área de saneamento ambiental e processos de desinfecção de água, ao aumento e diversificação da produtividade agrícola à custa de insumos químicos, bem como da bioquímica, que serve como base da medicina preventivas, desenvolvendo vacinas e novas drogas que aumentam a nossa longevidade. Assim em uma análise centrada em risco/benefício, os químicos podem se sentir muito à vontade para afirmar que suas contribuições têm sido crucial para a melhoria da qualidade de vida no planeta. No entanto, ainda há questões sem respostas, com por exemplo, qual a exatidão e magnitude do efeito estufa e quais suas consequências. Ou ainda, não se tem respostas sobre a toxicidade de todas as novas moléculas que são produzidas.
Cabe a todas as Disciplinas de estudo promover a qualidade de vida de toda a humanidade e respeitando e preservando todas as formas de vida do Planeta.
Mesmo com todos os avanços na área da ciência, ainda vemos grandes populações privadas de algumas tecnologias básicas.E daí encontramos um mudo com grandes injustiças sociais, e países sendo classificados como "desenvolvidos" ou "subdesenvolvidos" ou ainda em "desenvolvimento". A grande reflexão que nós químicos devemos fazer é o quanto temos contribuído para intensificação dessas desigualdades e o que podemos fazer para reversão dessa situação. E daí talvez consigamos enxergar através das vidraças do laboratório uma população e um ambiente que precise cada vez mais de nós.
A importância da Química é cada vez mais crescente para o meio ambiente. Encontrar soluções para o paradigma entre a necessidade de consumo dos recursos naturais e sua preservação é um dos papéis importantes da Química de hoje. Alguns exemplos da atuação da Química, pode-se citar como a produção de produtos biodegradáveis, recuperação de rios poluídos, a reciclagem de resíduos, o tratamento de esgotos e outros.
A partir da década de 60 o mundo foi tomado por uma nova ordem. A informação transformou nosso planeta em um sistema único e cada vez mais integrado. Quando vimos a primeira fotografia do nosso planeta tirada de uma nave espacial, descobrimos que a Terra é azul, flutuando no espaço. Descobrimos também o perigo dos pesticidas, do lixo urbano e industrial e que nosso ar estava se tornando cada vez mais poluído. O modelo econômico, mostrava-se claramente sua capacidade de destruição do nosso Planeta. Além, disso a indústria química era vista como um mero transformador dos recursos naturais para o consumo humano sem se importar com os rejeitos impactantes ao meio ambiente.
Embora com toda a informação e discussão sobre as questões ambientais ainda ocorrem muita desinformação ou contra-informação, o que às vezes dificulta a escolha da melhor opção preventiva ou mesmo paliativa para o problema. Parte desta desinformação pode ser atribuída a um erro histórico dos químicos. Há quatro décadas, quando deixou-se a sociedade sem respostas quando se questionaram, por exemplo, os riscos inerentes ao uso do DDT, dos metais pesados e da emissão de gases causadores de efeito estufa, dentro outros. Vem dessa época também a disseminação de um sentimento de associar a química com o impactante, o nocivo, o sintético (não-natural).
Os avanços da química impactaram, por outro lado, em grandes benefícios para o ser humano, como mostra, no Brasil, os dados do recentes do IBGE. A expectativa de vida do brasileiro passou de 43,3 anos, na década de 50, para 68,1 aos em 1998. Para exemplificar alguns avanços da química: na área de saneamento ambiental e processos de desinfecção de água, ao aumento e diversificação da produtividade agrícola à custa de insumos químicos, bem como da bioquímica, que serve como base da medicina preventivas, desenvolvendo vacinas e novas drogas que aumentam a nossa longevidade. Assim em uma análise centrada em risco/benefício, os químicos podem se sentir muito à vontade para afirmar que suas contribuições têm sido crucial para a melhoria da qualidade de vida no planeta. No entanto, ainda há questões sem respostas, com por exemplo, qual a exatidão e magnitude do efeito estufa e quais suas consequências. Ou ainda, não se tem respostas sobre a toxicidade de todas as novas moléculas que são produzidas.
Cabe a todas as Disciplinas de estudo promover a qualidade de vida de toda a humanidade e respeitando e preservando todas as formas de vida do Planeta.
Mesmo com todos os avanços na área da ciência, ainda vemos grandes populações privadas de algumas tecnologias básicas.E daí encontramos um mudo com grandes injustiças sociais, e países sendo classificados como "desenvolvidos" ou "subdesenvolvidos" ou ainda em "desenvolvimento". A grande reflexão que nós químicos devemos fazer é o quanto temos contribuído para intensificação dessas desigualdades e o que podemos fazer para reversão dessa situação. E daí talvez consigamos enxergar através das vidraças do laboratório uma população e um ambiente que precise cada vez mais de nós.
A importância da Química é cada vez mais crescente para o meio ambiente. Encontrar soluções para o paradigma entre a necessidade de consumo dos recursos naturais e sua preservação é um dos papéis importantes da Química de hoje. Alguns exemplos da atuação da Química, pode-se citar como a produção de produtos biodegradáveis, recuperação de rios poluídos, a reciclagem de resíduos, o tratamento de esgotos e outros.
Adicional acelerador de particulas
Faça você mesmo seu ACELERADOR DE PARTÍCULAS
Todo mundo gostaria de possuir uma belo acelerador de partículas, não é verdade?
Quem não gostaria de poder fornecer energia a feixes de átomos, elétrons, moléculas ou algumas partículas mais exóticas, como anti-prótons, pósitrons ou mésons, com velocidades altas, geralmente superiores a 1/1000 da velocidade da luz?Sem contar as exclusivas grandes vantagens de possuir um aparato desses, como:
Sintonizar muito mais canais de VHF e UHF em alta qualidade sem precisar de decodificadores e sem pagar assinatura!
* Fazer vitaminas de frutas frescas em menos de 10 nanosegundos.
Durante muito tempo isso era privilégio de poucos, como os franceses, os americanos, os suíços e até mesmo portugueses, que ficam expondo seus aceleradores para todos e vivendo dos lucros e das vantagens listadas acima.
Acelerador de partículas francês, americano, suíço e português, respectivamente.
Se você é uma pessoa normal que acha que não tem dinheiro ou até mesmo capacidade suficiente para ter um acelerador de partículas, esse tópico é para você! Por que, SIM, você pode! E hoje vamos explicar como. Tudo que você precisa para construir este incrível dispositivo é:
* 63 km de Tubos de PVC
* 12250 km de Fios de cobre
* 126728 litros de Mel
* 1 Bomba de encher pneu de bicicleta
* 1 Espátula
* 1 Pinça
* 1 Tesoura
* 1 Próton (sem elétron)
* 1 Folha de papel celofane
* Fita adesiva
* Veda-rosca
* 1 Rolha
* Ímãs de geladeira
* Barbante
* 1 Pá
* 100000 Pisca-piscas natalinos
O processo de construção é deveras trabalhoso, mas cá entre nós, vale a pena.
Inicialmente, encontre um terreno baldio, o mais próximo possível de sua casa, aquele terreno do lado de sua casa serve! Cave uma trincheira circular de 10 km de raio como no mínimo 2m de profundidade e 1m de largura. Despeje todo o mel nessa trincheira. Tape muito bem a trincheira e vamos à segunda parte da construção.
Conecte os tubos de PVC formando o mesmo circulo de 10km de raio. Essa parte é muito delicada e exige muita calma e precisão. Utilize o veda-rosca e a fita adesiva (sem economizar). O resultado deve ser algo parecido com isso:
O produto do seu trabalho até este momento
Lembre-se de deixar um pequeno acesso para que você possa inserir suas amostras no acelerador e outro para colocar o papel celofane (ambos muito bem vedados).
Agora que você já tem o duto principal, construa 1 eletroimã circular em volta do duto para cada 10cm de sua extensão. Desmonte os pisca-piscas, retirando as lampadinhas e os ligando aos eletroimãs de forma que quando ligado, os eletroimãs fiquem ligando e desligando sequencialmente (igual luminosos de Motel).
Pronto! Você pode inserir o duto na trincheira com o mel, fazendo com que o duto fique submerso. É importante não deixar entrar mel dentro do duto e lembre-se de deixar o acesso de inserção de partículas livre e do lado de fora! Feito isso tudo, pegue a bomba de encher pneu e inverta o tubo, para que ao se bombeá-la, sugue o ar em vez de soprar. Conecte-a ao duto principal, já submerso, e retire o ar de dentro do duto (esse processo pode levar algum tempo, e caso não seja possível criar um vácuo parcial, dentro do duto… faça outro duto melhor! Eu mesmo tive que fazer 4 vezer para dar certo). Tape o acesso com a rolha.
Então você já tem o duto, o vácuo e eletroimãs natalinos…. agora você só precisa do próton!
Encontrar um próton virgem (sem elétron) de bobeira por aí é fácil! Difícil é armazenar o safado! Para isso você pode construir uma armadilha eletromagnética para confinar o seu próton. Faremos o seguinte: com os imãs de geladeira, cola e muitas horas de aula de origami, você deve obter algo parecido com o dispositivo abaixo (eliminamos as linhas de campo para não dificultar a visualização esquemática da estrutura da armadilha).
Assim que conseguir um próton, prenda-o na sua armadilha e leve com muito cuidado até seu acelerador de partículas e, com a ajuda de mais alguém, coloque-o dentro do acelerador (usando a espátula e a pinça).
Como primeiro teste, coloque o papel celofane dentro da acelerador e ligue-o com o próton. Caso apareçam minúsculos (minúsculos mesmo) furinhos, é sinal de que deu certo!Você pode ficar feliz e saber que agora participa de um seleto grupo de pessoas; as pessoas que possuem aceleradores de partículas.
Ganhará sua carteirinha do CNaDAP (Clube Nacional de Donos de Aceleradores de Partículas) e nunca mais vai pagar ingresso inteiro no cinema, além de poder desvendar os grandes mistérios do mundo sub-atômico.
Todo mundo gostaria de possuir uma belo acelerador de partículas, não é verdade?
Quem não gostaria de poder fornecer energia a feixes de átomos, elétrons, moléculas ou algumas partículas mais exóticas, como anti-prótons, pósitrons ou mésons, com velocidades altas, geralmente superiores a 1/1000 da velocidade da luz?Sem contar as exclusivas grandes vantagens de possuir um aparato desses, como:
Sintonizar muito mais canais de VHF e UHF em alta qualidade sem precisar de decodificadores e sem pagar assinatura!
* Fazer vitaminas de frutas frescas em menos de 10 nanosegundos.
Durante muito tempo isso era privilégio de poucos, como os franceses, os americanos, os suíços e até mesmo portugueses, que ficam expondo seus aceleradores para todos e vivendo dos lucros e das vantagens listadas acima.
Acelerador de partículas francês, americano, suíço e português, respectivamente.
Se você é uma pessoa normal que acha que não tem dinheiro ou até mesmo capacidade suficiente para ter um acelerador de partículas, esse tópico é para você! Por que, SIM, você pode! E hoje vamos explicar como. Tudo que você precisa para construir este incrível dispositivo é:
* 63 km de Tubos de PVC
* 12250 km de Fios de cobre
* 126728 litros de Mel
* 1 Bomba de encher pneu de bicicleta
* 1 Espátula
* 1 Pinça
* 1 Tesoura
* 1 Próton (sem elétron)
* 1 Folha de papel celofane
* Fita adesiva
* Veda-rosca
* 1 Rolha
* Ímãs de geladeira
* Barbante
* 1 Pá
* 100000 Pisca-piscas natalinos
O processo de construção é deveras trabalhoso, mas cá entre nós, vale a pena.
Inicialmente, encontre um terreno baldio, o mais próximo possível de sua casa, aquele terreno do lado de sua casa serve! Cave uma trincheira circular de 10 km de raio como no mínimo 2m de profundidade e 1m de largura. Despeje todo o mel nessa trincheira. Tape muito bem a trincheira e vamos à segunda parte da construção.
Conecte os tubos de PVC formando o mesmo circulo de 10km de raio. Essa parte é muito delicada e exige muita calma e precisão. Utilize o veda-rosca e a fita adesiva (sem economizar). O resultado deve ser algo parecido com isso:
O produto do seu trabalho até este momento
Lembre-se de deixar um pequeno acesso para que você possa inserir suas amostras no acelerador e outro para colocar o papel celofane (ambos muito bem vedados).
Agora que você já tem o duto principal, construa 1 eletroimã circular em volta do duto para cada 10cm de sua extensão. Desmonte os pisca-piscas, retirando as lampadinhas e os ligando aos eletroimãs de forma que quando ligado, os eletroimãs fiquem ligando e desligando sequencialmente (igual luminosos de Motel).
Pronto! Você pode inserir o duto na trincheira com o mel, fazendo com que o duto fique submerso. É importante não deixar entrar mel dentro do duto e lembre-se de deixar o acesso de inserção de partículas livre e do lado de fora! Feito isso tudo, pegue a bomba de encher pneu e inverta o tubo, para que ao se bombeá-la, sugue o ar em vez de soprar. Conecte-a ao duto principal, já submerso, e retire o ar de dentro do duto (esse processo pode levar algum tempo, e caso não seja possível criar um vácuo parcial, dentro do duto… faça outro duto melhor! Eu mesmo tive que fazer 4 vezer para dar certo). Tape o acesso com a rolha.
Então você já tem o duto, o vácuo e eletroimãs natalinos…. agora você só precisa do próton!
Encontrar um próton virgem (sem elétron) de bobeira por aí é fácil! Difícil é armazenar o safado! Para isso você pode construir uma armadilha eletromagnética para confinar o seu próton. Faremos o seguinte: com os imãs de geladeira, cola e muitas horas de aula de origami, você deve obter algo parecido com o dispositivo abaixo (eliminamos as linhas de campo para não dificultar a visualização esquemática da estrutura da armadilha).
Assim que conseguir um próton, prenda-o na sua armadilha e leve com muito cuidado até seu acelerador de partículas e, com a ajuda de mais alguém, coloque-o dentro do acelerador (usando a espátula e a pinça).
Como primeiro teste, coloque o papel celofane dentro da acelerador e ligue-o com o próton. Caso apareçam minúsculos (minúsculos mesmo) furinhos, é sinal de que deu certo!Você pode ficar feliz e saber que agora participa de um seleto grupo de pessoas; as pessoas que possuem aceleradores de partículas.
Ganhará sua carteirinha do CNaDAP (Clube Nacional de Donos de Aceleradores de Partículas) e nunca mais vai pagar ingresso inteiro no cinema, além de poder desvendar os grandes mistérios do mundo sub-atômico.
sábado, 13 de junho de 2009
O tal acelerador de partículas que pode produzir buracos negros

Primeiramente o que é esse acelerador de particulas?
Os aceleradores de partículas são equipamentos que fornecem energia a feixes de partículas subatômicas eletricamente carregadas. Todos os aceleradores de partículas possibilitam a concentração de alta energia em pequeno volume e em posições arbitradas e controladas de forma precisa. Exemplos comuns de aceleradores de partículas existem nas televisões e geradores de raios-X, na produção de isótopos radioativos, na radioterapia do câncer, na radiografia de alta potência para uso industrial e na polimerização de plásticos.
O maior acelerador de particulas já construido é o LHC, que em operacão em maio é muito doido... Fiquei impressionada pela foto acima que é apenas de um dos detectores do LHC, é algo realmente gigantesco e supera tudo o que já vi em filmes de Ficção Científica na sua grandiosidade e complexidade.
Uma das coisas interessantes que ele deverá produzir são micro buracos negros. A foto ao lado que dá uma idéia do gigantismo do colisor.
O LHC é composto de um anel com 27Km de extensão (8,6Km de diâmetro) e está enterrado no solo a uma profundidade média de 100 metros. Ele irá acelerar prótons a velocidades próximas à da luz até colidirem e destas colisões espera-se chegar a respostas sobre a origem do universo.
O que se busca
A principal busca é pelo Bóson de Higgs, uma partícula que pelo modelo padrão da física deve ser a responsável pela massa de toda a matéria que existe no universo (e por conseguinte a gravidade). Esta partícula é tão importante que é chamada de Partícula de Deus. Micro buracos negros e monopólos magnéticos também estão entre o que se espera produzir por lá.
Muito interressante, mas muito complexo e esse negocio de produzir buracos negros e um tanto pouco intrigante.Então pesquisando encontrei o seguinte artigo:
Foi até criado um grupo de estudos dentro do CERN para garantir a segurança sobre o experimento e a conclusão é de que não há risco algum de que algo catastrófico venha a acontecer, até porque colisões de alta energia ocorrem o tempo todo na nossa atmosfera quando raios cósmicos entram em contato com o ar e, até hoje não há notícia de que fomos sugados por um buraco-negro …
Opa, será que já estamos dentro de um buraco-negro e não sabemos? Agora fiquei com medo
sexta-feira, 5 de junho de 2009
Explosão de substâncias químicas garante boas sensações do beijo apaixonado

Quem nunca teve um beijo de tirar o fôlego, daqueles que faz o coração bater mais forte? Na hora você é coberto por uma avalanche de emoções. É o momento que mistura, de maneira perfeita, os sentimentos românticos com os sexuais. O tempo pára e os minutos, que parecerem eternos, fazem você esquecer o resto do mundo. E essa sensação agradável proporcionada pelo beijo tem uma explicação científica.
Quando o ser humano beija, libera-se os chamados neurotransmissores, substâncias químicas que transmitem diferentes mensagens ao corpo, provando um estado de leveza física e emocial. Ou seja, beijar também relaxa. Essas substâncias são liberadas por um trabalho em conjunto do hipotálamo, hipófise e o tálamo. E surgem desse trabalho à “química do beijo”.
É do beijo também que surge a feniletilamina, uma das substâncias da paixão. A feniletilamina também pode ser desencadeada por um aperto de mão ou até mesma troca de olhar. Essa substância é conhecida há mais de 100 anos, no entanto, somente um estudo recente, realizado pelos doutores Donald F. Klein e Michael Lebowitz, do instituto Psiquiátrico Estadual de Nova York, foi descoberta a ligação entre o amor e a feniletamina. O cérebro de uma pessoa apaixonada contém maior quantidade de feniletilamina e esse “excesso” de quantidade é o responsável pelas sensações que surgem quando estamos apaixonados.
O ato de beijar também está relacionado com outros sentidos. Segundo o clínico geral Eduardo Henrique, durante o beijo “visualizamos a pessoa mais de perto, sentimos seu cheiro mais intensamente, sentimos seu gosto e tocamos na parte mais sensível do corpo, os lábios.”
Mas para liberar tanta emoção, exige-se bastante esforço. Quando beijamos alguém, são mobilizados 29 músculos, 17 só do corpo da língua. Ainda, ocorre aumento nos batimentos cardíacos, em média, o ritmo cardíaco altera de 70 para 150.
No beijo também ocorre troca de substâncias. Em média, 0,7 decigrama de albumina, 0,8 miligramas de matérias gordurosa, 0,5 miligramas de sais minerais e cerca de 9 miligramas de água. Além disso, são trocadas outras 18 substâncias orgânicas e, pasmem, cerca de 250 bactérias e vírus. Mas não precisa assustar. “Beijar não tem problema, o risco só existe quando uma das pessoas possui ferida aberta na cavidade oral, como úlceras”, esclarece Dr. Eduardo.
Apesar de aparentar ser um ato simples, o beijo é responsável por sentimentos e reações no organismo humano. E sem beijar, é impossível namorar ou amar alguém de verdade.
Portanto, aproveite a semana do beijo, se inspire e beije.
FONTE: INTERNET
CONHEÇA UM POUCO DA HISTÓRIA DOS SABONETES

Há indícios de que já na pré-história o ser humano fazia uso do sabão mesmo não sabendo da importância que um dia este produto teria para toda a humanidade. Segundo uma antiga lenda romana, a palavra 'sabão' teve sua origem no Monte Sapo, próximo à Roma, na Itália, onde animais eram oferecidos em sacrifício para os deuses. A gordura dos animais imolados no fogo misturava-se com a madeira queimada do altar. Esta mistura escorria para o solo nas proximidades de rios e as mulheres, ao lavarem roupas, sentiam uma maior facilidade em limpá-las quando estavam em contato com a nova substância.
O ano de 1878 foi um marco na história do desenvolvimento dos sabões modernos, quando foi inventado o sabão branco. Isto ocorreu acidentalmente, devido à inclusão de ar na solução de sabão antes da moldagem.
O uso medicinal dos sabões nos remete aos registros nos quais são mencionadas suas propriedades medicinais e de limpeza. Alguns estudiosos usaram sabão para tentar solucionar diversos problemas de pele, incluindo a escabiose, a psoríese, a tinea, o versicolor e a herpes tonsurans. Na Europa, no século XIX, foram descritos tratamentos com o uso do sabonete de versicolor da acne vulgar e da micose. E nos Estados Unidos, experimentaram tratar a acne com um sabão fino, feito de azeite de oliva e soda cáustica.
Na época de Napoleão, na Europa, o banho ainda não era um costume corrente e as pessoas não o praticavam. Nos tempos elisabetanos, o banho era um evento anual, felizmente, com a mudança das gerações, este hábito tornou-se diário, mostrando-se útil à remoção de microorganismos da pele, reduzindo, desta forma, o risco de infecções na mesma.
Os sabões são resultados da reação química entre a gordura e um álcali, resultando num sal ácido de gordura com ação detergente. O nome "sabonete" teve origem na França, onde se iniciou a confecção de sabões nos quais eram inseridas cores e aromas. A palavra em francês é "SAVONETE".
Na década de 50, com o desenvolvimento da indústria química e o ajuste das fórmulas, foi constatado um baixo índice de alergia ao uso de sabonetes, além de uma diminuição em seu custo. A função do sabonete consiste em emulsionar e suspender pequenas partículas sólidas da pele, que,desta forma, são eliminadas junto com a água, diminuindo o ressecamento da pele. A composição dos sabonetes podem ser incorporados óleos vegetais ou minerais.
Com o passar do tempo, as indústrias químicas desenvolveram sabonetes menos agressivos à pele, como os sabonetes de glicerina. Outras indústrias também auxiliaram esse desenvolvimento, criando equipamentos que tornaram a mão-de-obra das fábricas de sabonete mais rápida e eficiente.Atualmente, podemos preparar nossos próprios sabonetes, utilizando bases que são dissolvidas artesanalmente, adicionando a eles cores e aromas e ainda moldando-os em várias formas e tamanhos diferentes.
SABONETES COMERCIAIS
A carência de glicerina nos sabonetes comerciais é a principal razão do ressecamento que sentimos na pele com o seu uso. E muitas vezes vemos o próprio sabonete ressecar e rachar. Esta é a principal diferença entre os sabonetes comerciais e os sabonetes artesanais. Os ácidos graxos contidos nos óleos utilizados para se fazer o sabonete artesanal ajudam a regular a umidade e nutrir a pele, enquanto a glicerina natural dá uma textura mais macia.
Os sabonetes comerciais que você encontra nos supermercados são fabricados visando dois aspectos: a conservação do produto nas prateleiras do comércio e oferecer ao consumidor um produto de maior duração, com isso justificam o uso de produtos químicos e conservantes resultando em um produto que nem poderia mais ser chamado de sabão ou sabonete, na sua verdadeira acepção, pois nada mais são do que detergentes sintéticos, utilizando inclusive o hidróxido de sódio (soda cáustica). Muitos desses detergentes são à base de petróleo e outros que contêm substâncias encontradas na natureza, mas são extraídos radicalmente e modificado.
FONTE: INTERNET
Fogos de Artifício - A Química das cores ou as cores da Química?

Final de ano, nada mais comum que passar a virada do ano vendo o show de fogos de artifício, seja ao vivo ou pela TV. Quem nunca fez isso?
Shows de fogos de artifício são muito bonitos, no entanto, o barulho nas redondezas do espetáculo é gigantesco. E isso, é devido à grande quantidade de pólvora existente em um fogo de artifício.
Um fogo de artifício é composto basicamente por pólvora (mistura de enxofre, carvão e salitre 'nitrato de potássio') e por um sal de um elemento determinado (o que irá determinar a cor da luz produzida na explosão).
A pólvora foi bastante utilizada nos últimos séculos, principalmente, no século XX, durante a 1ª e 2ª Guerra Mundial. Geralmente, a descoberta da pólvora é atribuída aos chineses, que aparentemente a fizeram por volta do ano 1000 d.C. ou seja, por volta do século XI. Foi também os chineses que inventaram os fogos de artifício. Não como eles são encontrados hoje, mas de uma forma primária.
Na Europa, como é de conhecimento de muitos, ocorreram diversas guerras, dentro e patrocinadas por seus países. Isso ajudou no desenvolvimento de técnicas de trabalho com a pólvora e até a sua melhoria. Neste continente, a pólvora chegou por volta do século XIII ou XIV, mas só no século XVIII, durante a Revolução Francesa que a sua produção foi melhorada. Antoine Laurent Lavoisier, durante esta revolução, foi nomeado como o responsável pela munição, ou seja, pela pólvora. Até então, o salitre utilizado na produção de pólvora era obtido de forma primitiva e em pequenas quantidades. Lavoisier foi quem descobriu uma maneira de sintetizar o salitre em grandes quantidades, o que possibilitou um aumento sensível na produção e utilização da pólvora.
A pólvora, em um fogo de artifício, possui, além do nitrato de potássio (KNO3), perclorato de potássio (KClO4) ou clorato de potássio (KClO3). Estes compostos são denominados oxidantes e são altamente explosivos. A presença desses sais (KClO4 e KClO3) é uma forma de aumentar a explosão e a claridade proporcionada pelo fogo de artifício. Geralmente é utilizado sais de potássio, mas não de sódio, isso é devido ao fato dos sais de sódio absorverem água da atmosfera com maior facilidade do que os sais de potássio. Esse fato é o que impossibilita a utilização de sais de sódio em fogos de artifícios, uma vez que ao serem estocados, caso fossem feitos com sais de sódio, ocorreria a absorção de água, o que atrapalharia no momento da explosão do fogo. Além da intensa luz amarela que é obtida com os sais de sódio, que ofuscaria as outras cores.
A Química das cores dos fogos de artifício
As cores produzidas em um show de fogos de artifício são produzidas a partir de dois fenômenos, a incandescência e a luminescência.
A incandescência é a luz produzida pelo aquecimento de substâncias. Quando se aquece um metal, por exemplo, ele passa a emitir radiação infravermelha, que vai se modificando até se tornar radiação visível na cor branca. Isso irá depender de qual temperatura é atingida. Um exemplo de incandescência são as lâmpadas incandescentes, onde existe um filamento de tungstênio que é aquecido e passa a produzir luz, a partir da incandescência. Este fenômeno é, também, visto nos fogos de artifício, nos quais são utilizados metais como o alumínio e magnésio, que ao queimarem produzem alta claridade.
A luminescência é a luz produzida a partir emissão de energia, na forma de luz, por um elétron excitado, que volta para o nível de energia menos energético de um átomo.
Este fenômeno, a luminescência, pode ser explicado da seguinte forma: 1) Um átomo, de um elemento químico qualquer, possui elétrons em níveis de energia. Ao receber energia, estes elétrons são excitados, ou seja, são promovidos a níveis de energia mais elevados. A quantidade de energia absorvida por um elétron é quantizada, ou melhor, é sempre em quantidades precisas, não podendo ser acumulada. 2) O elétron excitado tem a tendência de voltar para o nível menos energético, pois é mais estável. Quando ocorre esta passagem, do nível mais energético para o menos, ocorre também a liberação da energia absorvida, só que agora, na forma de um fóton, ou seja, na forma de luz.
A luminescência é uma característica de cada elemento químico. Ou seja, átomos de sódio quando aquecido, emitem luz amarela, pela luminescência. Já os átomos de estrôncio e lítio produzem luz vermelha. Os de bário produzem luz verde e assim por diante.
Os fogos de artifício utilizam deste fenômeno e desta variedade, uma vez que há fogos das mais diversas cores. No entanto, nos fogos de artifício são utilizados sais destes elementos químicos, pois o elemento puro, é muitas vezes, reativo. Na tabela a seguir, há uma relação entre as cores e os sais dos elementos químicos utilizados para a sua produção.
Referência Bibliográfica
1-KOTZ, J., C., TREICHEL, P., Química e Reações Químicas, 3ª edição, volume 2; Rio de Janeiro, Editora LTC, 1998.
2-Tosi, L. Química Nova. 1989,12(1), 33-56.
http://www.quiprocura.net/fogo.htm
terça-feira, 2 de junho de 2009

Química
Estudo da química, indústrias químicas, elementos químicos, história da química, bioquímica, química orgânica, reações químicas.
A química é uma ciência que estuda as modificações e características dos elementos que encontramos na natureza. Esta importante ciência, através de técnicas específicas, desenvolve formas de sintetizar e purificar os elementos químicos. Muitas substâncias químicas são criadas a partir da união de determinados elementos naturais.
A química está presente em todos os lugares e em todas as coisas que podemos visualizar. Tudo em nosso planeta é formado por partículas, substâncias e elementos químicos. O átomo, por exemplo, a menor parte da matéria, está presente em tudo.
A indústria química trabalha no sentido de colocar os conhecimentos e procedimentos para a elaboração de produtos, alimentos e materiais de usos diversos.
Desde os primórdios da história o homem vem acumulando conhecimentos de química. Na Idade dos Metais, por exemplo, o homem pré-histórico utilizou conhecimentos básicos para poder produzir metais. Sem o conhecimento de determinados minérios e suas características principais, isso se tornaria impossível. Os egípcios, por exemplo, utilizaram conhecimentos de destilação e fermentação, para produzirem algumas bebidas como a cerveja.
Os árabes, no período de formação do Império Árabe ( século VIII ), desenvolveram muito a química através da chamada alquimia. Buscavam produzir a pedra filosofal e através destes estudos, descobriram a propriedade de diversas substâncias.
No Renascimento (séculos XV e XVI) a química vai atingir um grande avanço. Diversos cientistas, ansiosos em descobrir o funcionamento da natureza, vão embarcar em profundas experiências científicas, desenvolvendo diversos conhecimentos químicos.
Assinar:
Comentários (Atom)